








《原子光谱PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为2.43 MB,总共有44页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 44页
- 2.43 MB
- VIP模板
- ppt
- 数字产品不支持退货
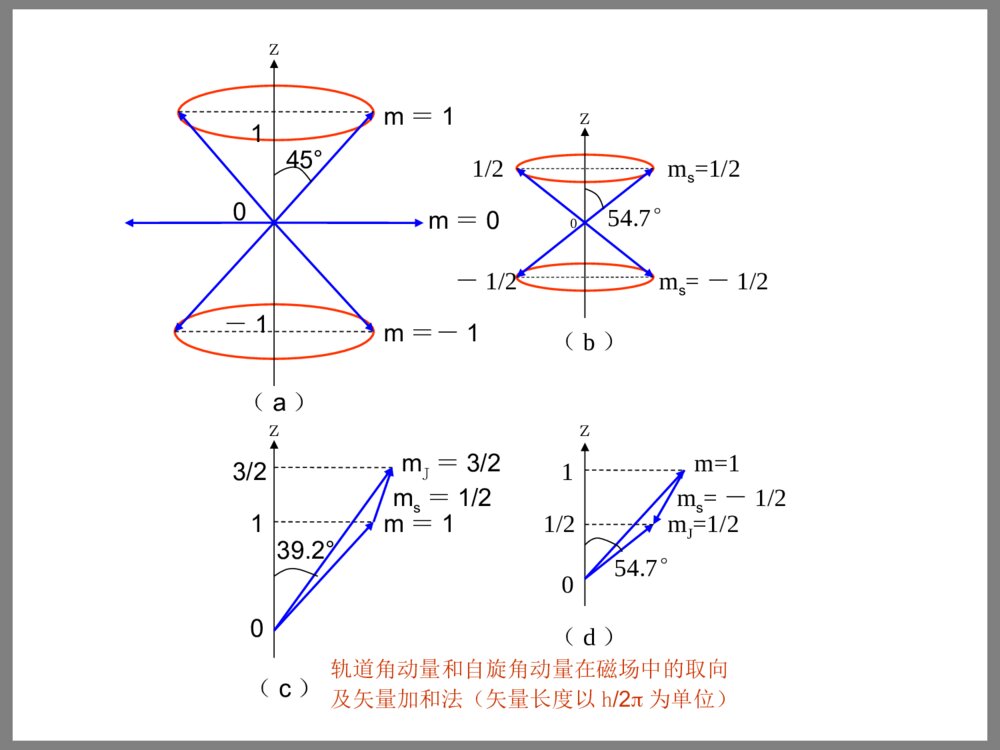
概念:◆基态:在无外来作用时,原子中各电子都尽可能处于最低能级,从而使整个原子的能量最低,原子的这种状态称为基态。◆激发态:当原子受到外来作用时,它的一个或几个电子吸收能量后跃迁到较高能级,从而使原子处于能量较高的新状态,此状态称作激发态。◆激发:原子由基态跃迁到激发态的过程叫做激发。◆退激:激发态是一种寿命极短的不稳定状态,原子随即跃迁回基态,这一过程叫做退激。◆原子发射光谱:原子从某一激发态跃迁回基态,发射出具有一定波长的一条光线,而从其它可能的激发态跃迁回基态以及某些激发态之间的跃迁都可发射出波长不同的光线,这些光线形成一个系列(谱),称为原子发射光谱。◆原子吸收光谱:将一束白光通过某一物质,若该物质中的原子吸收其中某些波长的光而发生跃迁,则白光通过物质后将出现一系列暗线,如此产生的光谱称为原子吸收光谱。◆光谱项:当某一原子由高能级E2跃迁到低能级E1时,发射出与两能级差相应的谱线,其波数可表达为两项之差:事实上,原子光谱中的任一谱线都可写成两项之差,每一项与一能级对应,其大小等于该能级的能量除以hc,这些项称为光谱项。Tn=En/hc●原子光谱是原子结构的反映,原子结构决定原子光谱的性质(成分和强度)。原子光谱是原子结构理论的重要实验基础之一,原子结构理论在原子光谱的测定、解释及应用等方面具有重要的指导意义。●光谱和结构之间存在着一一对应的内在联系。121212~TThcEhcEhcEE2122nRnR2.6.2电子的状态和原子的能态原子状态:各个电子的轨道运动和自旋运动状态的总和。原子组态:无磁场作用下的原子状态,用各电子量子数n、l表示。原子的微观状态:原子在磁场作用下的运动状态,用各电子量子数n、l、m、ms表示●原子的运动状态需用一套原子的量子数描述:□原子的角量子数L规定原子的轨道角动量:121-n,,,,0L2h1LLML□原子的磁量子数mL规定原子轨道角动量在磁场方向的分量:LhmMLzL,,2,1,02Lm□原子的自旋量子数S规定原子的自旋角动量:,2,1,0,25,23,212Sh1SSMS□原子的自旋磁量子数mS规定原子的自旋角动量在磁场方向的分量:SSShm,,2,1,0,,25,23,21S2mMzS□原子的总量子数J规定原子的总角动量(轨道和自旋):L-S,,S-1L,SLJ2)1(hJJMJ□原子的总磁量子数mJ规定原子的总角动量在磁场方向的分量:JJJzJhmM,,2,1,0,,25,23,212Jm●原子的每一光谱项都与一确定的原子能态相对应,而原子的能态可由原子的量子数(L,S,J)表示。因此,原子的光谱项可由原子的量子数来表示。●原子的微观能态:原子在磁场作用下的运动状态。原子的微观能态又与原子的磁量子数mL,mS和mJ有关。●原子的各种量子数可取哪些数值?如何由各个电子的量子数推求原子的量子数?关键是:①抓住各电子的轨道和自旋角动量的矢量加和这个实质问题;②正确理解电子的量子数和原子的量子数之间的关系;③电子的磁量子数在联系两套量子数中有重要作用。原子的光谱支项:2S+1LJ原子的光谱项:可由原子的量子数来表示,L值为0,1,2,3,4…的能态用大写字母S,P,D,F,G…表示,将(2S+1)写在L的左上角。原子的光谱支项将J写在L的右下角。原子的总角动量等于电子的轨道角动量和自旋角动量的矢量和.有两种加和法:(1)L–S耦合法:将每一电子的轨道角动量加和得到原子的轨道角动量,将每一电子的自旋角动量加和得到原子的自旋角动量,然后再将原子的轨道角动量和自旋角动量合成为原子的总角动量。(适用于原子序数小于40的轻原子)(2)j–j耦合法:先把每一电子的轨道角动量和自旋角动量合成为该电子的总角动量,然后再将每个电子的总角动量合成为原子的总角动量。(适用于重原子)原子的光谱项:2S+1L2.6.3单电子原子光谱项和原子光谱1.氢原子光谱项的推引对于(2p)1组态,l=1,m可为1,0,-1;s=1/2,ms可为1/2,-1/2。轨道角动量矢量长度为[l(l+1)]1/2=21/2,在z轴上的投影(m值)分别为1,0,-1。只要该角动量矢量分别与z轴形成45°,90°,135°锥角即可;自旋角动量矢量长度为[s(s+1)]1/2=31/2/2,欲使其z轴投影(ms)分别为1/2和-1/2,只需该矢量与z轴分别形成54.7°和125.3°锥角。m=1的轨道角动量和ms=1/2的自旋角动量在磁场中叠加,形成mJ=m+ms=1+1/2=3/2的总角动量矢量,其长度为151/2/2,与z轴呈39.2°锥角;m=1和ms=-1/2的两矢量加和,应得mJ=1/2的总角动量矢量,其模长为31/2/2,与z轴形成54.7°锥角。ms=-1/2zz0-1/21/254.7°ms=-1/2ms=1/2(b)zmJ=1/2m=1(d)54.7°01/21ms=1/245°39.2°01-1m=1m=0m=-1(a)z3/210mJ=3/2m=1(c)轨道角动量和自旋角动量在磁场中的取向及矢量加和法(矢量长度以h/2为单位)氢原子核外只有一个电子,该电子的轨道角动量和自旋角动量的矢量和就是氢原子的总角动量。组态为(2p)1时,p电子的l=1,m可为1,0,-1;s=1/2,ms可为1/2,-1/2.共得到mJ=3/2,1/2,1/2,-1/2,-1/2,-3/2这6个矢量。从mJ=3/2,1/2,-1/2,-3/2这4个值,推得原子的总量子数J=3/2;从mJ=1/2,-1/2,这两个数值,推得原子的总量子数J=1/2。■J=3/2和J=1/2代表两个总角动量矢量,其大小为:若不加外磁场,这两个总角动量没有特定的取向;在磁场中则有严格的定向关系,前者在磁场方向的分量只能为3/2,1/2,-1/2,-3/2个h/2;后者在磁场方向的分量只能为1/2,-1/2个h/2。212121212323hh和■无外加磁场且不考虑轨道运动和自旋运动相互作用时,(2p)1组态只有一个能级,光谱项为2P(L=1,S=1/2);由于轨道运动和自旋运动的相互作用,原子能态变为两个能级,光谱支项分别为2P3/2(J=3/2)和2P1/2(J=1/2);在外加磁场中,这两个能级又分别分裂为4个和2个微观能级。即2P谱项对应着6种微观能态,(2p)1组态对应着6种(3×2)微观状态。■同理可推得H原子(1s)1组态的光谱项为2S(L=0,S=1/2),光谱支项为:2S1/2(L=0,S=1/2,J=1/2,mJ=±1/2)■单电子原子某一组态的电子,其轨道角动量和自旋角动量的耦合是通过m和ms数值的加和得到所有可能的mJ,进而根据mJ和J的取值关系(mJ=±1/2,±3/2,…,±J)得出J的值。有了L和S,也可直接求出J(J=L+S,L+S-1,…,|L-S|),每个J之下可有J,J–1,J-2,…,-J,共(2L+1)个mJ值。电子的状态原子的能态lmms无外加磁场在外加磁场不考虑l-s耦合考虑l-s耦合考虑l-s耦合111111+1+1-1-100+1/2-1/2+1/2-1/2+1/2-1/2l=1(2P)J=3/2(2P3/2)J=1/2(2P1/2)mJ=3/21/2-1/2-3/21/2-1/2156234表2.6.3氢原子的微观状态和微观能态s1:L=0;S=1/22S+1L=2S→2S+1LJ(J=1/2)=2S1/2p1:L=1;S=1/22S+1L=2P→2S+1LJ(J=1/2,3/2)=2P3/2,2P1/2d1:L=2;S=1/22S+1L=2D→2S+1LJ(J=5/2,3/2)=2D3/2,2D5/22.氢原子(2p)1(1s)1跃迁的光谱•氢原子发射光谱的选率:△n任意;△L=±1;△J=0,±1;△mJ=0,±1▲无外加磁场,使用低分辨率仪器,2p→1s跃迁只出现一条谱线;无外加磁场,使用高分辨率光谱仪,可看出上述谱线的精细结构,它是由两条靠得很近的谱线组成;若外加很强的磁场,且用分辨率很高的光谱仪,则可观察到5条谱线(按选率应出现6条谱线,△J=0与△mJ=0对应,△J=±1与△mJ=±1对应,c,d两条线因能级差相同而重叠)。无外加磁场外加强磁场低分辨率高分辨率高分辨率mJ2p1s822592P3/22P1/22S1/282259.2782258.91abcdef1/2a,bc,de,f3/21/21/2-1/2-1/2-3/2-1/2H原子2p→1s跃迁的能级和谱线(单位:㎝-1)碱金属原子只有1个价电子,其余(Z-1)个电子与核一起形成原子实,在普通的原子光谱中,原子实没有变化,所以碱金属原子光谱类似于氢原子光谱。钠原子的基态为[Ne](3s)1,激发态的价电子可为(np)1、(nd)1(n=3,4,5,…)或者为(ns)1、(nf)1(n=4,5,6,…)。钠的黄色谱线(D线)为3p→3s跃迁所得谱线。(3p)1组态有两个光谱支项:2p3/2和2p1/2,所以D线为双线,它们对应的跃迁及波数如下:nmcmSsPpnmcmSsPp9963.58804.16978335930.58985.1696033121223212122123.碱金属原子光谱2.6.4多电子原子光谱项1.多电子原子光谱项的推求()Ⅰ非等价电子组态①先由各电子的m和ms求原子的mL和mS:iiSiiLmmmms,②mL的最大值即L的最大值;L还可能有较小的值,但必须相隔1(L的最小值不一定为0);共有多少个L值,L的最小值是多少,需用矢量加和规则判断。一个L之下可有0,±1,±2,…,±L共(2L+1)个不同的mL值。③mS的最大值即是S的最大值;S还可能有较小的值,但必须不断减1,S减到何值为止,也需核对mS值的个数;一个S下可有S,S-1,S-2,…,-S共(2S+1)个不同的mS。④由L和S值求出J值,写出所有光谱项和光谱支项:对每一L和S按J=L+S,L+S-1,…,∣L-S∣推出所有可能的J值,每个J之下有J,J-1,J-2,…,-J共(2J+1)个mJ值。●每个光谱支项2S+1LJ有(2J+1)个微观能态(mJ值),每个光谱项的微观能态数为(2S+1)(2L+1)个。比如,3D光谱项:L=2,S=1,J=3,2,1,(2S+1)(2L+1)=3×5=1515753)12(31JJ例如,(2p)1(3p)1组态:由l1=1,m1=1,0,-1和l2=1,m2=1,0,-1可知,共有3×3=9个mL值;则,L=2,1,0(5+3+1=9);由(ms)1=1/2,-1/2和(ms)2=1/2,-1/2知,共有2×2=4个mS值;则,S=1,0(3+1=4);将L和S组合,得6个光谱项(3×2=6):3D,3P,3S,1D,1P,1S;将L和S进行矢量加和求出J值,得到与每个光谱项对应的光谱支项为:3D3,3D2,3D1,3P2,3P1,3P0,3S1,1D2,1P1,1S0;6个光谱项的微观能态数共为:15+9+3+5+3+1=36种由(2p)1组态推得单电子体系共有6个微观能态,(2p)1(3p)1组态为两个非等价电子组合,所以,共有6×6=36种微观能态。2p13p1:p1p1l1=1,l2=1→L=2,1,0;s1=1/2,s2=1/2.→S=1,0.3D→3D3,3D2,3D13P→3P2,3P1,3P03S→3S11D→1D21P→1P11S→1S0微观能态3D(15);3P(9);3S(3);1D(5);1P(3);1S(1)共36种微观能态.2s13s1:L=0;S=1,0.3S→3S11S→1S02s12p1:L=1;S=1,03P→3P2,3P1,3P01P→1P1⑴非等价电子组态每一光谱项的微观能态数目为(2S+1)(2L+1)3s13d1:L=2;S=1,03D→3D3,3D2,3D11D→1D23p13d1:L=3,2,1;S=1,03F→3F4,3F3,3F23D→3D3,3D2,3D13P→3P2,3P1,3P01F→1F31D→1D21P→1P14d15d1:L=4,3,2,1,0;S=1,03G→3G5,3G4,3G33F→3F4,3F3,3F23D→3D3,3D2,3D13P→3P2,3P1,3P03S→3S11G→1G41F→1F31D→1D21P→1P11S→1S0s1s1s1:s1s1:3S,1Ss1:L=0;S=1/2{3S:L=0;S=1;s1:L=0;S=1/2}→→{L=0;S=3/2,1/2}→{4S→4S3/2,2S→2S1/2}{1S:L=0;S=0;s1:L=0;S=1/2}→→{L=0;S=1/2}→{2S→2S1/2}p1p1p1:p1p1:3D,1D,3P,1P,3S,1Sp1:L=1;S=1/2{3D:L=2,S=1;p1:L=1,S=1/2}→{L=3,2,1;S=3/2,1/2}→→{4F,2F;4D,2D;4P,2P}{1D:L=2,S=0;p1:L=1,S=1/2}→{L=3,2,1;S=1/2}→→{2F;2D;2P}{3P:L=1,S=1;p1:L=1,S=1/2}→{L=2,1,0;S=3/2,1/2}→→{4D,2D;4P,2P;4S,2S;}{1P:L=1,S=0;p1:L=1,S=1/2}→{L=2,1,0;S=1/2}→→{2D;2P;2S}{3S:L=0,S=1;p1:L=1,S=1/2}→{L=1;S=3/2,1/2}→→{4D;2P}{1S:L=0,S=0;p1:L=1,S=1/2}→{L=1;S=1/2}→{2P}p1p1p1:{4F(1),4D(2),4P(3),4S(1),2F(2),2D(4),2P(6),2S(2)}p1p1d1:p1p1:3D,1D,3P,1P,3S,1Sd1:L=2;S=1/2{3D:L=2,S=1;d1:L=2,S=1/2}→{L=4,3,2,1,0;S=3/2,1/2}→{4G,4F,4D,4P,4S;2G,2F,2D,2P,2S}{1D:L=2,S=0;d1:L=2,S=1/2}→{L=4,3,2,1,0;S=1/2}→→{2G,2F,2D,2P,2S}{3P:L=1,S=1;d1:L=2,S=1/2}→{L=3,2,1;S=3/2,1/2}→→{4F,4D,4P;2F,2D,2P}{1P:L=1,S=0;d1:L=2,S=1/2}→{L=3,2,1;S=1/2}→→{2F,2D,2P}{3S:L=0,S=1;d1:L=2,S=1/2}→{L=2;S=3/2,1/2}→→{4D;2D}{1S:L=0,S=0;d1:L=2,S=1/2}→{L=2;S=1/2}→{2D}p1p1d1:{4G,4F(2),4D(3),4P(2),4S;2G(2),2F(4),2D(6),2P(4),2S(2)}p1d1d1:p1d1:3F,3D,3P,1F,1D,1Pd1:L=2;S=1/2{3F:L=3,S=1;d1:L=2,S=1/2}→{L=5,4,3,2,1,0;S=3/2,1/2}→{4H,4G,4F,4D,4P;2H,2G,2F,2D,2P}{3D:L=2,S=1;d1:L=2,S=1/2}→{L=4,3,2,1,0;S=3/2,1/2}→{4G,4F,4D,4P,4S;2G,2F,2D,2P,2S}{3P:L=1,S=1;d1:L=2,S=1/2}→{L=3,2,1;S=3/2,1/2}→→{4F,4D,4P;2F,2D,2P}{1F:L=3,S=0;d1:L=2,S=1/2}→{L=5,4,3,2,1;S=1/2}→→{2H,2G,2F,2D,2P}{1D:L=2,S=0;d1:L=2,S=1/2}→{L=4,3,2,1,0;S=1/2}→→{2G,2F,2D,2P,2S}{1P:L=1,S=0;d1:L=2,S=1/2}→{L=3,2,1;S=1/2}→→{2F,2D,2P}p1d1d1:{4H(1),4G(2),4F(3),4D(3),4P(3),4S(1);2H(2),2G(4),2F(6),2D(6),2P(6),2S(2)}F原子的基组态为(1s)2(2s)2(2p)5。与上述理由相同,该组态的光谱项和光谱支项只决定于(2p)5组态。根据等价电子组态的“电子—空位”关系,(2p)5组态与(2p)1组态具有相同的谱项。因此,本问题转化为推求(2p)1组态的光谱项和光谱支项。这里只有一个电子,S=½,L=1,故光谱项为2P。又,因此有两个光谱支项:2121123211JJ或212232PP和[解]:Na原子的基组态为(1s)2(2s)2(2p)6(3s)1。其中1s、2s和2p三个电子层皆充满电子,它们对整个原子的轨道角动量和自旋角动量均无贡献。Na原子的轨道角动量和自旋角动量仅由3s电子决定;L=0,S=1/2,故光谱项为2S;J只能为1/2,故光谱支项为2/12S2.20.写出Na原子的基组态、F原子的基组态和碳原子的激发态(1s22s22p13p1)存在的光谱支项符号。对C原子激发态(1s)2(2s)2(2p)1(3p)1,只考虑组态(2p)1(3p)1即可。2P和3P电子是不等价电子,因而(2p)1(3p)1组态不受Pauli原理限制,可按下述步骤推求其谱项:由。因此可得6个光谱项:3D,3P,3S,1D,1P,1S。根据自旋一轨道相互作用,每一光谱项又分裂为数目不等的光谱支项,例如,对3D光谱项,,S=1,L=2,S和L组合可得J=3,2,1,因而它分裂为3D3,3D2,3D13个支项。6个光谱项共分裂为10个光谱支项:3D3,3D2,3D1,3P2,3P1,3P0,3S1,1D2,1P1,1S0。0,121,21;0,1,21,12121SssLll得由得2.多电子原子的能级●组态和微观状态是原子状态的表示,而光谱项、光谱支项和微观能态则是原子能级的表示。●忽略电子的相互作用时,原子能级只与主量子数有关,一个组态只对应一个能级;由于电子间相互作用,原子能级分裂为不同的光谱项;由于轨道-自旋相互作用,同一光谱项分裂为不同的光谱支项;在外加磁场的作用下,每一光谱支项右分裂为不同的微观能态,这种分裂称为Zeeman效应。。●每一组态所包含的微观状态数与微观能态数严格相等,但二者间并无一一对应关系。●多电子原子光谱的选率:△S=0;△L=0,±1;△J=0,±1(J=0→J′=0除外);△mJ=0,±1。mJ=0mJ=210-1-2mJ=210-1-2mJ=10-1mJ=0abcdem10-1(np)21S1D3P1S01D23P23P13P0(np)2组态的能级分裂a—微观状态(有磁场);b—组态,不考虑电子相互作用(无磁场);c—光谱项,考虑电子的相互作用(无磁场);d—光谱支项,考虑L-S的相互作用(无磁场);e—微观能态(有磁场)和相同,Hund规则:①SL愈大,能量愈低;②S相同,L愈大,能量愈低;③SJ半满或未半满,愈小能量愈低;半满以上,愈大能量愈低。LJJ3.原子光谱项能级高低的判断光谱项中,表示能量最低的谱项——光谱基项●全充满的电子层,自旋相互抵消,各电子的轨道角动量的矢量和也正好抵消,推导光谱项时可不予考虑。●基态最稳定光谱支项推导实例:例1:C(2p)2,mS=1,S=1;mL=1,L=1;L-S=0;∴3P0。例2:Ti(3d)2,mS=1,S=1;mL=3,L=3;L-S=2;∴3F2。例3:Br(4p)5,mS=1/2,S=1/2;mL=1,L=1;L+S=3/2;∴2P3/2。例4:H(1s)1,mS=1/2,S=1/2;mL=0,L=0;L-S=1/2;∴2S1/2。例5:N(2p)3,mS=3/2,S=3/2;mL=0,L=0;L-S=3/2;∴4S3/2。例6:O(2p)4,mS=1,S=1;mL=1,L=1;L+S=2;∴3P2。例7:F(2p)5,mS=1/2,S=1/2;mL=1,L=1;L+S=3/2;∴2P3/2。例8:Ne(2p)6,mS=0,S=0;mL=0,L=0;L+S=0;∴1S0。写出下列原子能量最低的光谱支项的符号:(a)Si;(b)Mn;(c)Br;(d)Nb;(e)Ni解:写出各原子的基组态和最外层电子排布(对全充满的电子层,电子的自旋相互抵消,各电子的轨道角动量矢量也相互抵消,不必考虑),根据Hund规则推出原子最低能态的自旋量子数S、角量子数L和总量子数J,进而写出最稳定的光谱支项。pSLLmSmLs3;0;1,1;1,10(a)Si:[Ne]3s23p2(b)Mn:[Ar]4s23d510121012256;25;0:,0;25,25SSLLmSmLs[2.19](c)Br:[Ar]4s23d104p5(d)Nb:[Kr]5s14d4101232;23;1,1;21,21PSLLmSmLs210120216;21;2,2;25,25DSLLmSmLs(e)Ni:[Ar]4s23d821012434;3,3;1,1FSLLmSmLs;[解]:分别求出,两种电子组态能量最低的光谱支项,与实验结果对照,即可确定正确的电子组态。组态a:。因此,能量最低的光谱支项为3F4,与光谱实验结果相同。组态b:。因此,能量最低的光谱支项为3D3,与光谱实验结果不同。所以,基态Ni原子的电子组态为[Ar]3d84s2。 ab4;3,3;1,1SLLmSmLs3;2,2,1,1SLLmSmLs[2.22].基态Ni原子可能的电子组态为:(a)[Ar]3d84s2;(b)[Ar]3d94s1,由光谱实验确定其能量最低的光谱支项为3F4。式判断它是哪种组态。1.原子发射光谱和原子吸收光谱原子外层电子从高能态回到低能态或基态上,同时以光的形式放出多余的能量,原子发射光谱。原子由基态激发至高能态时,需要的能量是一定的,只有符合此能值的光才会被基态原子所吸收,原子吸收光谱。2.原子的X射线谱原子的特征X射线是由原子的内层电子跃迁时产生的。3.X射线荧光分析利用能量足够高的X射线(或电子)照射试样,激发出来的光叫X射线荧光。利用X射线荧光光谱仪分析X射线荧光光谱,鉴定样品的化学成分称为X射线荧光分析。4.电子探针电子探针是对试样进行微小区域成分分析的仪器,全名为电子探针X射线显微分析仪,又叫区微X射线谱分析仪。2.6.5原子光谱的应用



















